2015年,澳门大学徐仁和教授团队与爱姆斯坦共同合作,发表于Stem Cells(IF=6.023)上的Immune Modulatory Mesenchymal Stem Cells Derived from Human Embryonic Stem Cells Through a Trophoblast-Like Stage的研究成果证实,T-MSC相较骨髓干细胞(BM-MSC)在治疗多发性硬化、炎症性肠病等多种疑难病中,表达更低的促炎因子、具有更好的免疫调节作用、对疾病损伤后的修复效果更强,整体疾病治疗效果更好,为多种自身免疫性疾病、退行性疾病、遗传性疾病治疗和治愈增加了信心。

此项研究依托爱姆斯坦的胚胎干细胞来源间充质干细胞分化应用技术平台(T-MSC),将人胚胎干细胞系(hESC)高效率、高质量地通过胚外滋养层细胞(Trophoblast-like)中间体,分化成间充质样干细胞(简称为T-MSC),在接近批准用于临床试验的较低剂量条件下,对患有两种不同自身免疫性疾病的小鼠进行治疗,治疗结果显示,T-MSC有效的弥补了治疗中BM-MSC在安全性和有效性中的不足。
研究背景
人类间充质干细胞(MSC)因其表现出的优异的自我更新、多向分化和免疫调节能力,已被作为主要的干细胞治疗类型应用于疑难病的治疗和研究中,而骨髓(BM)又是MSC最常见的组织来源,因此BM-MSC成为目前干细胞治疗研究中最常见的干细胞类型。
随着BM-MSC在各种疾病治疗研究的深入和丰富,多项基础研究以及Ⅱ/Ⅲ期临床试验结果显示,使用成人组织分离的MSC尤其是BM-MSC在治疗中存在几个关键缺点,阻碍了其向标准疗法发展[1, 2]:体外扩增与细胞治疗效力降低[1, 3];受供体质量差异影响可用性被极大限制[2];易受环境变化的影响,在炎症环境时可能失去免疫抑制功能[4, 5]。
作为无限细胞来源的hESCs具备自我更新和多能性的同时,分化过程中可以保障重复地形成质量一致的MSCs,成为MSCs的一种稳定来源。与BM来源的MSCs相比,hESCs来源的MSCs在疾病治疗研究中产生较少的促炎因子,免疫原性较低。
本项研究发现通过添加骨形态发生蛋白4(BMP4)后,hESC可成功分化为滋养细胞 (TBs)[6],TBs可促进构成MSC主要来源绒毛膜的形成,意味着TB可能具有分化为MSC的潜力。
此项研究结果证明,MSC可以通过滋养细胞中间阶段从hESC中衍生,形成MSC(T-MSC),且衍生出的T-MSC具有优异的多能性和免疫调节能力,并且可以对促炎细胞因子干扰素-γ(IFNγ)反应,降低两种炎症疾病模型中小鼠的疾病程度。
研究方法
hESCs通过定向分化技术经由TBs增殖后,形成间充质样干细胞(T-MSC),并对T-MSC进行MSC表征常规鉴定,通过建立多发性硬化小鼠模型及结肠炎小鼠模型等自身免疫性疾病的动物模型对治疗效果进行对比鉴定分析。
研究结果
1. T-MSC具备MSC所有的表型及分化潜力
T-MSC技术可以实现,3-5天内将hESC扩大形成TB样细胞,11-16天内形成间充质样干细胞(T-MSC)(图1A)。分化期间,T-MSC标志物表达逐渐上升,并在体外以指数增长率增殖至五代后,仍具备MSC的表型及分化潜力。(图1)
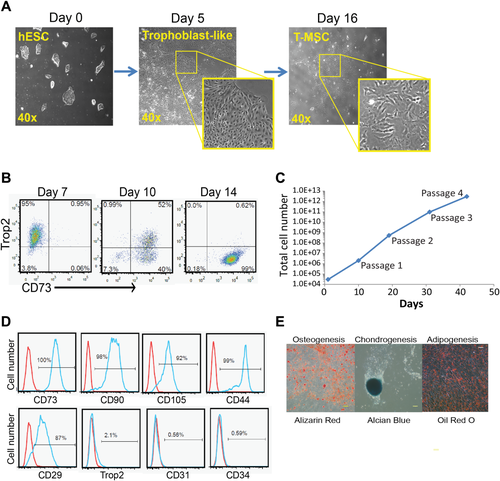
2. T-MSC具有更优异的免疫调节作用
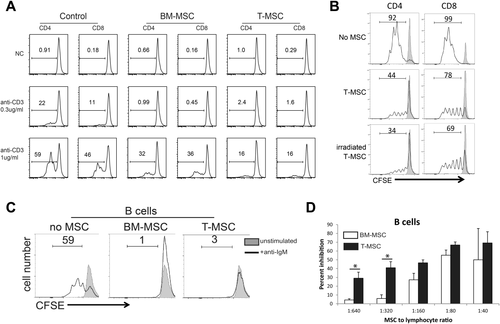
实验中通过刺激小鼠总淋巴细胞,并通过CFSE稀释测量细胞增殖情况发现,与BM-MSC对比,T-MSC对T细胞和B细胞(T、B淋巴细胞属于免疫细胞的一种)都表现出优异的免疫抑制特性,因此T-MSC具备治疗由T细胞或B细胞介导炎症性疾病的潜力。(图2)
3. T-MSC对IFNγ的促炎介质表达更低
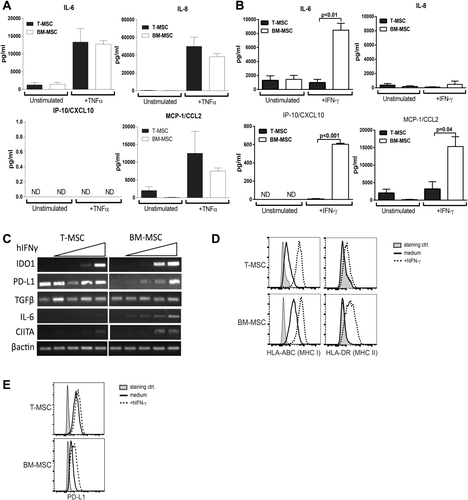
处于炎症环境中时(即暴露于促炎细胞因子如IFNγ或肿瘤坏死因子α(TNFα)时),MSC免疫抑制功能的激活是非常重要的。实验发现在TNFα刺激下,BM-MSC和T-MSC都增加了IL-6、IL-8和CCL2等相关促炎因子的分泌,而在IFNγ刺激下,T-MSC相比于BM-MSC不表达IL-6等促炎因子,且免疫耐受基因不受炎症反应影响,具有有效调节免疫系统的能力(图3 A-C、E)。结果显示,炎症刺激环境下,T-MSC的免疫原性显著低于BM-MSC。(图3)
4. T-MSC减少结肠炎小鼠的结肠损伤
硫酸葡聚糖钠诱导的小鼠结肠炎是最常用的动物模型之一,类似于人类溃疡性结肠炎,具有上皮细胞死亡、肠上皮屏障功能丧失,以及巨噬细胞和T细胞浸润的特征。在该动物模型中,使用T-MSC与PBS(对照组)治疗后发现,与PBS(结肠炎评分为1有0/9只小鼠)相比,经T-MSC治疗降低了大多数小鼠(肠炎评分为1有7/10只小鼠)的结肠炎恶化程度,并且减少肠上皮损坏程度,恢复了体重。(图4)

5. T-MSC能够预防小鼠实验性自身免疫性脑脊髓炎(EAE)多发性硬化模型疾病发作并降低疾病严重程度
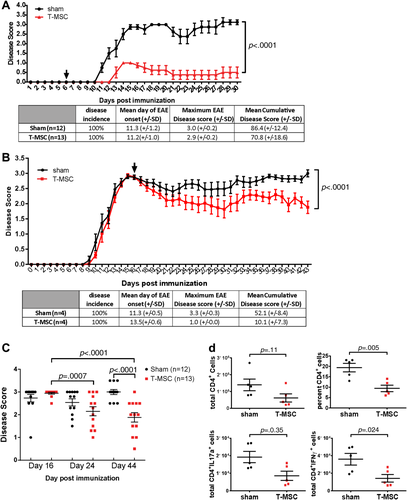
在多发性硬化症的EAE动物模型中,在疾病发作前和疾病发作后的两个阶段,给小鼠注射T-MSC或PBS(对照组)进行对比分析。经T-MSC的治疗组,在疾病发作前和疾病发作后的两个阶段中EAE疾病评分持续降低,且浸润中枢神经系统的致病性CD4+Th1 (IFNγ+)和Th17 (IL17a+) T细胞总数减少,因此实验结果证实T-MSC对EAE具有优异的预防和治疗功效。(图5)
小结
该项研究证实,通过TB样中间阶段,经过滋养细胞阶段,可以高效的从hESC中无限次的、衍生出质量一致的T-MSC。
而T-MSC与BM-MSC相比,具有更优异的抗炎活性、免疫原性,在多发性硬化和炎症性肠病等免疫性疾病的治疗研究中具有更优的治疗效果潜力,为该类疑难病的治疗带来了新的希望。
作者简介
王小方研究员
T-MSC关键发明人,目前该技术取得发明专利11项,北京大学医学院七年制临床医学本硕连读;德克萨斯大学休斯顿健康科学中心(University of Texas Health Science Center at Houston)免疫学博士; 耶鲁大学、康涅狄格大学博士后。
徐仁和教授
胚胎干细胞技术的奠基人,其无血清培养技术已成为业界主流技术。人体胚胎干细胞之父James Thomson的第一位研发合作伙伴,拥有核心发明专利10余项,发表论文80余篇,获引用7000多次。澳门大学健康科学学院副院长,杰出教授;曾任康涅狄格大学(University of Connecticut)教授、干细胞中心主任。湖南医科大学(现中南大学湘雅医学院)药理学硕士,东京大学(The University of Tokyo)发育生物学博士。
文献来源
KYRIAKOU C, RABIN N, PIZZEY A, et al. Factors that influence short-term homing of human bone marrow-derived mesenchymal stem cells in a xenogeneic animal model [J]. Haematologica, 2008, 93(10): 1457-65.
GALIPEAU J. The mesenchymal stromal cells dilemma--does a negative phase III trial of random donor mesenchymal stromal cells in steroid-resistant graft-versus-host disease represent a death knell or a bump in the road? [J]. Cytotherapy, 2013, 15(1): 2-8.
GIULIANI M, FLEURY M, VERNOCHET A, et al. Long-lasting inhibitory effects of fetal liver mesenchymal stem cells on T-lymphocyte proliferation [J]. PLoS One, 2011, 6(5): e19988.
DARLINGTON P J, BOIVIN M N, RENOUX C, et al. Reciprocal Th1 and Th17 regulation by mesenchymal stem cells: Implication for multiple sclerosis [J]. Ann Neurol, 2010, 68(4): 540-5.
ANTON K, BANERJEE D, GLOD J. Macrophage-associated mesenchymal stem cells assume an activated, migratory, pro-inflammatory phenotype with increased IL-6 and CXCL10 secretion [J]. PLoS One, 2012, 7(4): e35036.
XU R H, CHEN X, LI D S, et al. BMP4 initiates human embryonic stem cell differentiation to trophoblast [J]. Nat Biotechnol, 2002, 20(12): 1261-4.


